
Ectopia lentis y síndrome de Marfan: diagnóstico diferencial con el síndrome de Weill-Marchesani, homocistinuria y síndrome de Stickler
La presencia de ectopia lentis o subluxación del cristalino es un hallazgo característico en el síndrome de Marfan, y constituye un criterio mayor en su diagnóstico. Sin embargo, la presencia de esta alteración ocular no es específica del síndrome de Marfan. De hecho, se halla en otras entidades poco frecuentes, por lo que el conocimiento de éstas es importante para evitar falsos diagnósticos, con las consecuentes implicaciones que se derivan.
Ectopia lentis
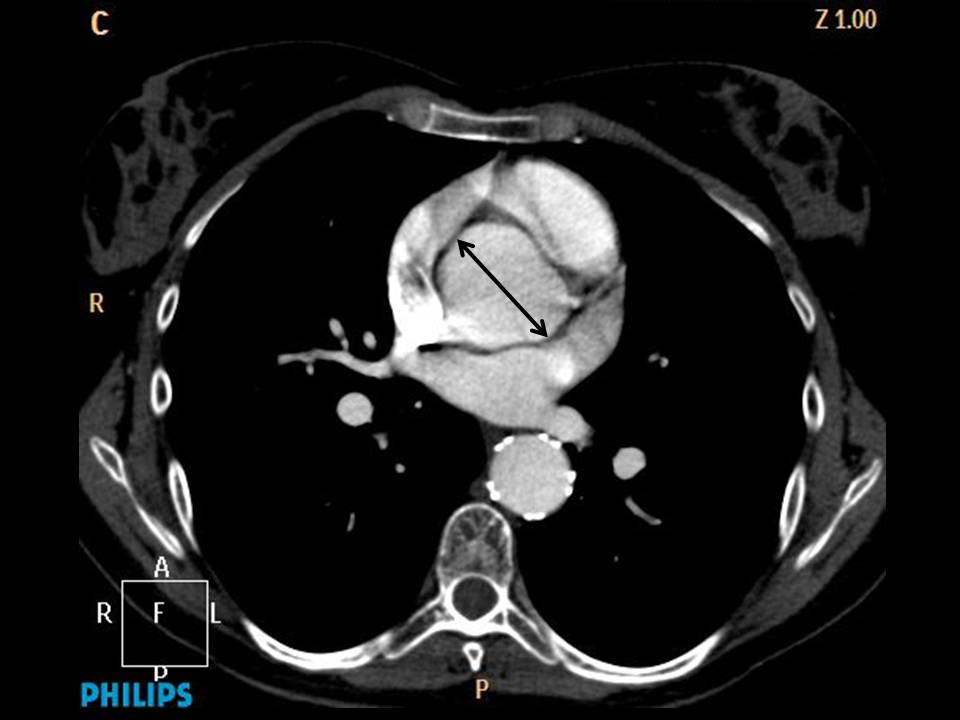
En el síndrome de ectopia lentis familiar se hallan típicamente algunas manifestaciones esqueléticas del síndrome de Marfan e incluso mutaciones en el gen de la fibrilina 1 (FBN1). Aunque este síndrome se caracteriza por la ausencia de enfermedad aórtica (figura 1), puede ser difícil distinguir un síndrome de Marfan en desarrollo o emergente en ausencia de un familiar afectado o en individuos jóvenes. La presencia de aneurisma aórtico o historia familiar de enfermedad aórtica, o la identificación de mutaciones en el gen FBN1 previamente asociado a aneurisma aórtico, es suficiente para cambiar el diagnóstico a síndrome de Marfan, independientemente del número y distribución de hallazgos o anomalías sistémicas. Para asegurarse que no haya errores dependientes del crecimiento, no debe realizarse el diagnóstico de ectopia lentis familiar por debajo de los 20 años de edad. El síndrome de ectopia lentis es una alteración genéticamente heterogénea, con herencia autosómica dominante, causada por mutaciones en el gen de la fibrilina 1 y por mutaciones recesivas en LTBP2 y ADAMTSL4.
(http://www.rarediseases.org/)

Homocistinuria
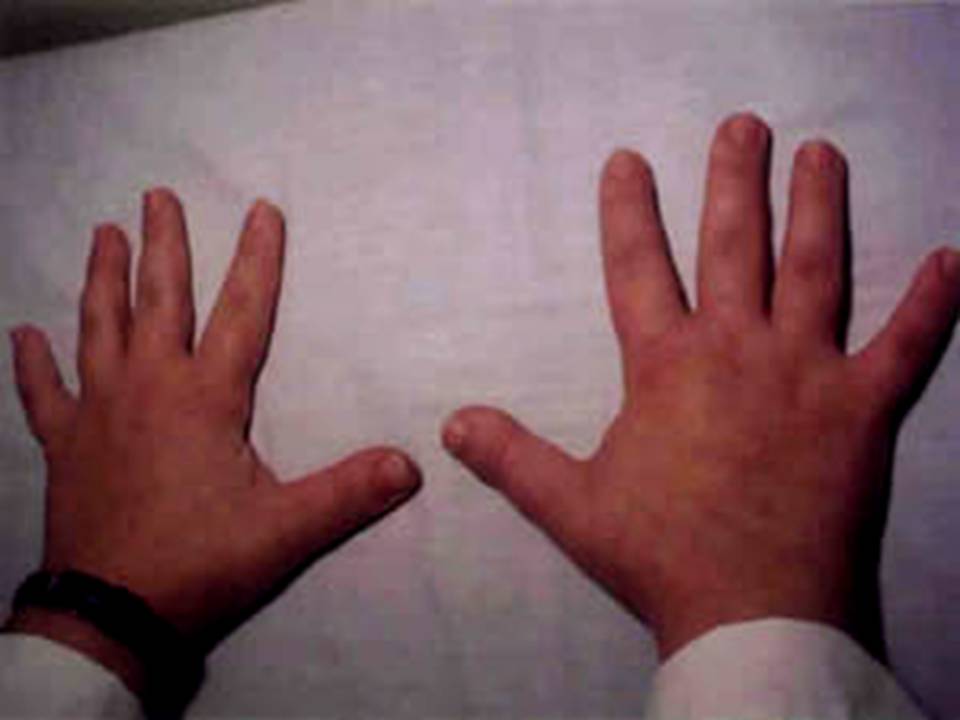
La homocistinuria, enfermedad metabólica con herencia autosómica recesiva causada por deficiencia en la cistationina beta-sintasa, se caracteriza por la presencia de retraso mental, ectopia lentis, miopía severa, anormalidades esqueléticas y fenómenos tromboembólicos. Los pacientes afectos tienden, además, a presentar un hábito asténico, semejante al del síndrome de Marfan. El hallazgo bioquímico cardinal es la elevación marcada de las concentraciones de homocisteína en plasma, homocisteína total y metionina; concentración elevada de homocisteína en orina; y una actividad enzimática reducida de la cistationina beta-sintasa. La homocistinuria es fácilmente diferenciable del síndrome de Marfan por la presencia de retraso mental y trombosis, y puede ser excluida por análisis de aminoácidos en orina en ausencia de tratamiento con suplementos de piridoxina. En la Homocistinuria, el cristalino se disloca generalmente hacia abajo debido a la pérdida completa de soporte ciliar de la zónula.
(http://www.sindromedestickler.com/)
El síndrome de Stickler es una enfermedad genética del tejido conectivo de carácter progresiva. Este síndrome afecta a entre 1 y 3 personas por cada 10 000, y generalmente se trasmite de padres a hijos, con una probabilidad del 50 % de que los hijos desarrollen la enfermedad, aunque también se han registrado casos en los que los niños la desarrollan por primera vez en la familia.
Se han encontrado hasta ahora tres genes que participan en el desarrollo del síndrome: COL2A1, COL11A1 y COL12A1; el primero representa la mayoría de los casos (75 %), y los síntomas (articulares, auditivos y oculares) afectan a todo el cuerpo, al igual que el segundo gen. Sin embargo, el tercero es una variación del síndrome, que recibe también el nombre de displasia oto-espondilo-metafisiaria, que afecta solamente a las articulaciones y a la audición, en tanto que deja la vista casi intacta. Hay registros de un cuarto grupo, cuya causa genética está aún por determinar.
En el síndrome de Stickler los pacientes pueden presentar un hábito marfanoide y los signos oculares incluyen la degeneración vítrea, el desprendimiento de retina, la miopía y el glaucoma de ángulo abierto. Son comunes las cataratas precoces, pero no la subluxación del cristalino.
Bibliografía
Ades LC, et al. Am J Med Genet A 2004;126ª:284-9
Desir J, et al. Eur J Hum Genet 2010;18:761-7
Ahram D, et al. Am J Hum Genet 2009;84:274-8
Faivre L, et al. Am J Med Genet 2003; 123A:204-7
Rezvani I. Defects in metabolism of amino acids. In: Kliegman RM, Behrman RE, Jenson HB, Stanton BF. Nelson Textbook of Pediatrics. 18th ed. Philadelphia, Pa: Saunders Elsevier; 2007:chap 85.
Naiglin L, et al. Ann Genet. 1999;42(3):140-6.
Al suscribirse al blog, te enviaremos un correo electrónico cuando haya actualizaciones en el sitio, de manera que no te las pierdas.



Comentarios